Esipuhe
Digitalisaatio muuttaa yhteiskunnan toimintaa kaikilla sektoreilla, niin myös terveydenhuollossa. Muutoksen tuulet puhaltavat myös kliinisissä lääketutkimuksissa.
Naapurimaissamme viranomaiset ovat julkaisseet ohjeistuksia ja pilotoivat tutkimusten hajautusta ja virtualisointia. Pitkään jatkunut teknologian kehittyminen ja toisaalta äkillinen resurssien kohdentaminen pois tutkimuksesta koronapandemian hoitoon ovat vauhdittaneet muutosta. Otimme Sitrassa haasteen vastaan ja lähdimme selvittämään, mitä esteitä ja mahdollisuuksia kliinisten lääketutkimusten tekemiseen hajautus ja virtuaalisuus Suomessa tuovat.
Työhypoteesimme oli alussa melko luontevasti, että digitaalisuus ja datan edistyksellinen käyttö mahdollistaisi hajautettua toimintamallia, parantaisi kansalaisten osallistumismahdollisuuksia ja voisi toimia Suomen kilpailukykyä lisäävänä tekijänä. Selvitystyömme ei kumonnut hypoteesia, mutta toi eteemme hyvin moninaisen kliinisen lääketutkimuksen maailman, jossa ei ole helppoja voittoja.
Ovatko hajautus ja virtuaalisuus merkittäviä tekijöitä kliinisen lääketutkimuksen kasvulle? Ne eivät yksin riitä kääntämään tutkimusten laskutrendiä kasvuun, mutta niiden tarjoamaa mahdollisuutta ei kannata ohittaa.
Suomen kattavat terveystiedot, kansallisiin digitaalisiin ratkaisuihin tottunut kansa ja innovaatioille myönteiset viranomaiset ovat kilpailuvalttejamme, joita pitäisi pystyä paremmin hyödyntämään myös kliinisissä lääketutkimuksissa. Terveyssektorin kilpailukyvyssä moni asia on keskinäisessä riippuvuussuhteessa ja käsillänne olevaa työpaperia on hyvä lukea rinnakkain maaliskuussa 2022 julkaisemamme Terveysdatan sujuva ja turvallinen käyttö – Viisi askelta kohti reilua datataloutta 2030 -työpaperin kanssa.
Sitra rakentaa eurooppalaiseen arvopohjaan perustuvaa ihmislähtöistä ja reilua datataloutta. Terveysdata 2030 -projektissa keskitymme terveysdatan käytön edistämiseen Suomessa ja Euroopassa. Tavoitteenamme on, että Suomen terveys- ja hyvinvointialan toimintaympäristö kehittyy terveysdatan käytön edelläkävijäksi, minkä ansiosta kansalaiset saavat terveyshyötyjä ja yhteiskunta talouskasvua. Lisäksi edistämme Suomen aktiivista roolia Euroopan kestävässä digitalisaatiokehityksessä ja koordinoimme EU:n TEHDAS-yhteistoimintahanketta.
Haluan kiittää kaikkia työpaperiin haastateltuja sidosryhmiä ja erityisesti Kasve Oy:ta, joka toteutti esiselvityksen kliinisten lääketutkimusten tilasta Suomessa.
Hyviä lukuhetkiä!
12.5.2022
MARKUS KALLIOLA
Projektijohtaja, Terveysdata 2030, Sitra
Tiivistelmä
Kliinisillä lääketutkimuksilla selvitetään lääkkeiden tehoa ja turvallisuutta. Ne ovat tarkasti rajattuja ja niihin kohdistuu yksityiskohtaista sääntelyä. Ne kestävät jopa 15 vuotta ja maksavat sadoista miljoonista jopa miljardeihin euroihin. Perinteisesti lääketutkimuksiin osallistuvat potilaat matkustavat tutkimuskeskuksiin toimenpiteitä, kuten mittauksia tai lääkkeiden annostelua, varten.
Hajautettu ja virtuaalinen lääketutkimus hyödyntää digitaalisia ja fyysisiä ratkaisuja, jotka mahdollistavat lääketutkimuksen toteutuksen paikasta riippumattomasti. Hajautetut ja virtuaaliset lääketutkimukset pyrkivät tuomaan potilaan lääketutkimusten keskiöön ja vähentämään tai jopa täysin poistamaan potilaan tarpeen matkustaa tutkimuskeskukseen toimenpiteitä varten.
Onnistuessaan hajautetut ja virtuaaliset lääketutkimukset voivat parantaa datan laatua, tarjota jatkuvaa tietoa potilaan tilasta, helpottaa potilaiden rekrytointia ja vähentää potilaiden tarvetta keskeyttää tutkimus. Samalla ne haastavat nykyisiä toimintamalleja esimerkiksi vähentämällä fyysisen kontaktin avulla havaittuja mahdollisia sivuvaikutuksia tai siirtämällä tietojen kirjaamista ammattilaisilta potilaille tai esimerkiksi etäluettaville verensokerimittareille.
Suomella on erinomainen tilaisuus nousta hajautettujen ja virtuaalisten lääketutkimusten edelläkävijäksi. Mahdollisuuksia on sekä toimia kokeiluympäristönä hajautetuille ja virtuaalisille menetelmille sekä toimia lääketutkimusten kohdemaana hajautuksen avulla.
Suomen tulee kuitenkin selkeyttää toimintaympäristöä, tuoda tärkeimmät toimijat yhteen, markkinoida vahvuuksiaan nykyistä vahvemmin, tukea yleishyödyllisiä uudenlaisia tutkimuksia sekä parantaa yleisiä lääketutkimusten vaatimia toimintaedellytyksiä, kuten koulutusta ja rahoitusta.
1. Lääketutkimuksilla selvitetään lääkkeiden tehoa ja turvallisuutta
Kliiniset lääketutkimukset vaativat merkittäviä investointeja ja kestävät pitkään. Suomessa lääketutkimusten määrä on laskussa.
Lääketutkimukset ovat monivaiheisia ja noudattavat yksityiskohtaista sääntelyä
Kliinisen lääketutkimuksen tavoitteena on osoittaa tarkasteltavan lääkkeen tehokkuus ja turvallisuus ihmisille. Tämä toteutetaan yleensä vertaamalla lääkettä kontrolliryhmään, joka voi saada lumehoitoa, normaalien hoitokäytänteiden mukaista hoitoa tai ei mitään hoitoa. Lopputuloksena saadaan tietoa lääkkeen hyödyistä ja haitoista.
Kliiniset lääketutkimukset on perinteisesti jaoteltu useisiin vaiheisiin (taulukko 1). Nykyään nämä rajat eivät ole enää niin selkeitä ja usein tutkimuslupia haetaan samaan aikaan eri vaiheisiin. Ennen kliinisiä vaiheita kartoitetaan mahdollisia lääkeaihioita niin sanotussa pre-kliinisessä vaiheessa, johon sisältyy sekä lääkeaineiden kartoitus (engl. discovery research) että testaus. Prekliinisessä vaiheessa käytetään erilaisia laboratoriotutkimuksia ja koe-eläimiä. Näiden vaiheiden tavoitteina on tunnistaa potentiaalisia lääkeaineita kliiniseen tutkimukseen ja arvioida niiden turvallisuutta ennen varsinaisten kliinisten kokeiden aloittamista ihmisillä.
Taulukko 1. Lääketutkimukset jaetaan vaiheisiin.
| Vaihe | Pre-kliininen | Vaihe 1 | Vaihe 2 | Vaihe 3 | Vaihe 4 |
| Tavoite | Lääkeaineiden tunnistus | Turvallisuuden ja annostuksen määrittely | Vaikuttavuuden ja pitkäaikaisten sivuvaikutusten tunnistus | Vaikuttavuuden ja pitkän ajan sivuvaikutukset | Markkinalla olevan lääkeaineen seuranta |
| Kohde ja määrä | Laboratorio ja eläimet, 1000–10 000 lääkeainetta | 20–100 tervettä vapaaehtoista | 100–500 potilasta | 1000–5000 potilasta | |
| Kesto | 5–7 vuotta, jatkuvaa | n. 1 vuosi | 1–3 vuotta | 2–4 vuotta | Jatkuva |
Modernit lääketutkimukset vaativat potilaiden ja hoitohenkilökunnan lisäksi muitakin rooleja:
- Potilas tai osallistuja on vapaaehtoinen, jolle tarjotaan hoitoa
- Hoitohenkilökunta (kutsutaan usein kliinikoiksi) tekee toimenpiteet ja kirjaa tulokset. Nämä henkilöt tekevät päivätyönään usein normaalia hoitotyötä lääkäreinä ja hoitajina
- Tutkimuskoordinaattori hallinnoi lääketutkimusta
- Tutkimuskeskuksissa tehdään toimenpiteitä ja koordinoidaan tutkimusta
- Sponsori maksaa tutkimuksen. Käytännössä nämä ovat pääasiassa lääkeyhtiöitä, jotka muodostavat Suomessa noin 75 prosenttia tutkimuslupien hakijoista (PDF). Loput sponsorit ovat akateemisia, kuten yliopistoja
- Tutkimuksen sisäinen valvonta varmistaa, että tutkimus noudattaa eettisiä ja sisäisiä sääntöjä
- Viranomaisvalvonta varmistaa, että tutkimuksissa noudatetaan lainsäädäntöä ja sääntöjä. Viranomaisilta haetaan myös tutkimusluvat ja onnistuneen tutkimuksen jälkeen myyntilupa
- Lisäksi tutkimuksiin liittyy paljon muita tärkeitä tehtäviä, kuten tietojen tarkistus, potilaiden rekrytointi ja taloushallinto
Lääkeyhtiöt eivät tee lääketutkimusten potilastyötä. Suomessa tästä vastaavat tutkijalääkärit ja tutkimushoitajat, jotka työskentelevät terveyspalveluiden tuottajilla, kuten keskussairaaloissa tai yksityisissä terveyspalveluyrityksissä.
Tutkimuksen käytännön hallinta tai osa siitä on usein ulkoistettu tutkimuspalveluyrityksille (engl. contract research organisation, CRO). Lääkeyhtiö toimii tutkimuksen rahoittajana ja seuraa sen edistymistä, ja CRO ohjaa tutkijoita. Lääketutkimukset muodostavat usein toimijoiden verkoston. Mukana tutkimuksissa on usein yliopistoja, sairaaloita ja järjestöjä. Tutkimus keskittyy harvoin vain yhteen maahan, vaan tutkimuksia tehdään yleensä eri maissa. Akateemisissa tutkimuksissa tehdään yleensä sopimus lääkeyhtiön kanssa lääkeaineiden sponsoroinnista tutkimuksen toteutusta varten.
Lääketutkimuksiin liittyvät viranomaiset ja julkiset toimijat Suomessa on koottu taulukkoon 1. Lääkealan turvallisuus- ja kehittämiskeskus Fimea vastaa tutkimusten valvonnasta ja myöntää tutkimuslupia. Valtakunnallinen lääketieteellinen tutkimuseettinen toimikunta (Tukija) on keskitetty toimija, joka arvioi lääketutkimuksia eettisestä näkökulmasta.
Taulukko 1. Tärkeimmät lääketutkimuksiin liittyvät viranomaiset ja toimijat Suomessa
| Toimija | Vastuut | Tehtävä |
| Fimea | Valvova viranomainen | Lupa tutkimukselle |
| Tukija | Tutkimusten eettinen arviointi | Puoltava lausunto kliinisistä lääketutkimuksista, Fimeasta riippumaton taho |
| Tietosuojavaltuutetun toimisto | Tietosuojakysymysten ja henkilötietojen käsittelyn arviointi | Lausunnot viranomaiselle, esim. Findata |
| Sosiaali- ja terveysministeriö | Lainsäädäntöä valmisteleva viranomainen | Hallituksen esitykset |
| Yliopistosairaalat | Tutkimuksen tekeminen, koulutus ja erikoissairaanhoito | Julkaisut, tutkinnot yhteistyössä yliopiston kanssa, tehokkaat hoitomenetelmät, dataa omista rekistereistä |
| Yliopistot | Tutkimuksen tekeminen ja opetus | Julkaisut |
| Parlamentaariset päättäjät, hallitusohjelmat | Päätösten tekeminen | Lainsäädäntö |
| THL | Rekisterinpitäjä monille rekistereille | Rekisteridata tieteellistä tutkimusta varten |
Lääketutkimukset ovat kalliita ja kestävät pitkään
Lääketutkimuksia on hyvin erilaisia. Niitä kuitenkin määrittävät usein korkeat kustannukset ja pitkä kesto. Orion arvioi keskimääräisen onnistuneen lääkkeen kehittämiseen kuluvan 700–800 miljoonaa euroa ja 10–15 vuotta. Riippumaton selvitys Yhdysvalloissa päätyi keskimääräisten kustannusten osalta 1,3 miljardiin dollariin, kun taas lääkeyhtiöiden omiin tietoihin perustuva arvio päätyi 2,9 miljardiin dollariin.
Riippumatta tarkoista luvuista, lääkkeiden kehitys on kallista ja se kestää pitkään. Samalla ne tuovat merkittävästi investointeja ja niiden työllistävä vaikutus on suuri. Vain alle 15 prosenttia lääketutkimuksista johtaa hyväksyntään.
Lääketutkimuksista on merkittävää hyötyä Suomelle. Lääketutkimukset tarjoavat potilaille mahdollisuuden saada uutta hoitoa jo ennen niiden markkinalle tuloa. Onnistuneen lääketutkimuksen tuloksena samat lääkkeet saadaan kaikkien potilaiden saataville olettaen, että myyntilupa myönnetään ja lääke tulee osaksi hoitokäytäntöjä.
Hoitohenkilökunnan osaaminen kehittyy, kun he voivat osallistua uusien lääkkeiden tutkimukseen. Terveyspalveluiden tuottaja yleensä hyötyy lääketutkimuksesta, koska sponsoria laskutetaan toteutettuihin toimenpiteisiin perustuen. Lääketutkimukset rakentavat myös ekosysteemiä, jonka sisällä syntyy yrityksiä, innovaatioita ja jaetaan tietoa tehostaen nykyistä toimintaa.
2. Hajautetut ja virtuaaliset lääketutkimukset helpottavat potilaiden osallistumista ja tutkijoiden työtä
Hajauttaminen ja virtuaalisuus tarjoavat uusia toteutustapoja lääketutkimukseen ja haastavat nykyisiä toimintamalleja. Ne voivat vähentää potilaskohtaisia kustannuksia, lisätä tietoa ja helpottaa potilaiden osallistumista. Ruotsissa ja Tanskassa uutta tutkimustapaa edistetään aktiivisesti.
Virtuaalisuus ja paikkariippumattomuus mahdollistavat uudenlaisia lääketutkimuksia
Kliinisten lääketutkimusten ytimessä ovat tiedon kerääminen, tallentaminen ja analysointi. Tietoa tuottavat potilaat, hoitohenkilökunta, tietojärjestelmät ja laitteet.
Koronapandemian takia lääketutkimuksia toteuttavat organisaatiot ovat joutuneet ottamaan käyttöön virtuaalisia ja hajautettuja menetelmiä, koska potilaat eivät ole joko halunneet tai voineet käydä fyysisesti vastaanotolla. Samalla viranomaiset ovat joutuneet tehostamaan merkittävästi toimintaansa erityisesti koronaan liittyvissä tutkimuksissa. Vaikka lääketutkimukset ovat joutuneet ennen näkemättömien haasteiden eteen, niiden määrä jatkoi maailmanlaajuisesti kasvuaan vuonna 2020 ja 2021.
Kliiniset lääketutkimukset toteutetaan pääosin monipaikkaisesti useissa tutkimuskeskuksissa. Vain noin 20 prosenttia Suomessa tehtävistä lääketutkimuksista rajoittuu yhteen tutkimuskeskukseen. Kliinisiä lääketutkimuksia tehdään myös yli maiden rajojen.
Hajautetut ja virtuaaliset lääketutkimukset (engl. decentralised and virtual clinical trials) voidaan määrittää monella tavalla. Määritelmänä tässä työpaperissa käytetään seuraavaa:
Hajautettu ja virtuaalinen lääketutkimus hyödyntää digitaalisia ja fyysisiä ratkaisuja, jotka mahdollistavat lääketutkimuksen toteutuksen paikkariippumattomasti.
Hajautetun lääketutkimuksen sijaan olisi täsmällisempää puhua hajautetuista ja virtuaalisista lääketutkimuksista, mutta käytämme terminä hajautettua lääketutkimusta yksinkertaisuuden ja sen vakiintuneisuuden takia erityisesti englanninkielisessä kirjallisuudessa. Virtuaalisuudella saavutetaan kuitenkin hajautusta.
Hajautettu lääketutkimus ei ole selkeästi perinteisistä lääketutkimuksista erotettava kategoria, vaan näiden välillä on vuorovaikutussuhde (kuva 1). Käytännössä esimerkiksi tutkimuksen ensimmäiset ja viimeiset tutkimukset voitaisiin suorittaa fyysisesti tutkimuskeskuksessa ja muut etänä digitaalisia työkaluja hyödyntäen.
Hajauttamisen ja virtuaalisuuden sijasta olisi syytä alkaa puhua potilaskeskeisistä lääketutkimuksista, koska se on hajautuksen ja virtuaalisuuden päätarkoitus. Hajautus ja virtuaalisuus eivät ole itseisarvoja, vaan niillä tavoitellaan yhä vahvempaa keskittymistä potilaaseen ja helpotetaan osallistumista. Ne voivat myös helpottaa kliinikkojen rekrytointia.
Kuva 1. Paikkariippuvaisesta lääketutkimuksista siirrytään vaiheittain virtuaalisiin ja paikasta riippumattomiin tutkimuksiin
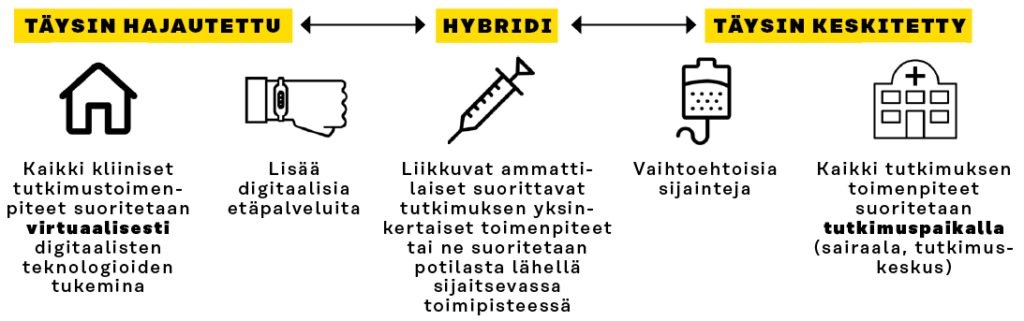
Työkalut ja ratkaisut, kuten elektroninen suostumus, etävastaanotot ja potilaiden seuranta etänä, mahdollistavat lääketutkimusten paikkariippumattomuutta. Perinteiset ratkaisut, kuten hoitajien tekemät kotikäynnit, linja-autoon rakennettu vastaanotto tai kotiin toimitettavat lääkeaineet, mahdollistavat yhä laajempaa hajautusta ja potilaskeskeisyyttä.
Tärkeintä on suunnitella lääketutkimukset potilaiden ehdolla. Kliinisiin tutkimuksiin keskittyvän verkoston Clinical Trials Arenan teettämän kyselyn mukaan etäsuostumuksen, internetkyselyjen ja happisaturaatiomittareiden kaltaiset työkalut yleistyvät nopeasti lääketutkimusten virtualisoinnissa.
Hajautetut ja virtuaaliset keinot sujuvoittavat lääketutkimuksia
150 tutkimuksen analyysin mukaan (PDF) hajautettuja elementtejä hyödyntävät kliiniset lääketutkimukset ovat taloudellisesti kannattavampia, tutkimusten kesto on lyhyempi ja potilaiden rekrytoinnin haasteista johtuva tutkimusten keskeyttäminen on epätodennäköisempää.
Tärkein hajautettujen lääketutkimusten hyöty on potilaskeskeisyys. Center for Information and Study on Clinical Research Participation (CISRP) Yhdysvalloissa teettämään kyselyyn vastanneista 75 prosenttia on kiinnostuneita osallistumaan kliinisiin lääketutkimuksiin (PDF). Suomesta ei ole vastaavaa tutkimusta tarjolla viimeiseltä 10 vuodelta. Pitkien välimatkojen Suomessa virtuaalisuus voisi lisätä halukkuutta ja mahdollisuuksia osallistua tutkimuksiin. Suomessa keskimääräinen matka-aika yliopistosairaalaan on noin tunti, kun taas terveysasemalle se on alle 10 minuuttia. Pienestä väestöpohjasta myös seuraa harvempi tutkimuskeskusten verkosto.
Potilaiden rekrytointiin ja tutkimuksen keskeyttämiseen liittyvät kustannukset ovat merkittävä osa lääketutkimuksia. Yhdysvalloissa potilaiden rekrytointiin käytetään noin neljännes lääketutkimusten kustannuksista, mutta noin kolmasosa potilasta keskeyttää tutkimuksen lisäten edelleen kustannuksia. Suomessa vastaavia lukuja ei ole tarjolla. Hajautetut lääketutkimukset voivat sekä helpottaa potilaiden rekrytointia että vähentää tutkimuksen keskeyttävien potilaiden määrää. Potilaat voidaan valita esimerkiksi perustuen kotona tehtävään kyselyyn tai näytteenottoon. Kustannukset voivat myös laskea työmäärän vähentymisen ja etävastaanottojen fyysisiä vastaanottoja matalampien kustannuksien kautta.
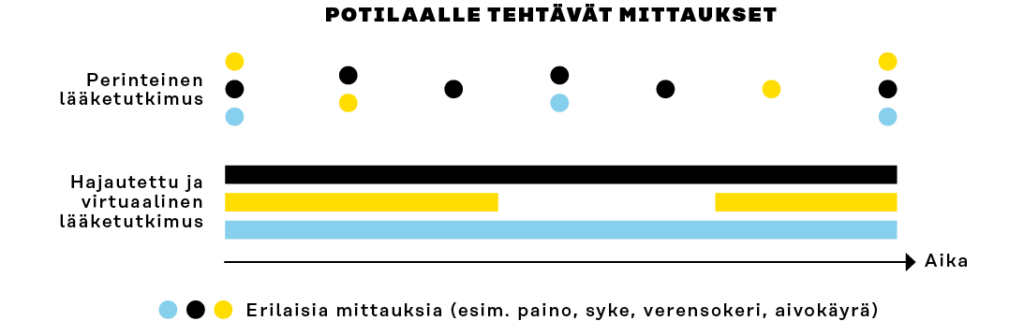
Hajautetut lääketutkimukset mahdollistavat tavanomaista tehokkaamman ja reaaliaikaisemman tietojen keruun, kun hyödynnetään digitaalisia työkaluja. Esimerkiksi matkapuhelimen tai sykemittarin kautta lähetettävät tiedot voidaan kirjata automaattisesti. Tiedonsiirto on myös lähes reaaliaikaista. Verrattaessa paperisiin potilaiden täyttämiin päiväkirjoihin digitaaliset päiväkirjat vähentävät työmäärää ja nopeuttavat tietojen varmistamista. Suurempi datamäärä myös mahdollistaa niin sanotun datatieteen (engl. data science) menetelmien, kuten koneoppimisen, hyödyntämistä kerättyyn dataan. Nykyinen lupakäytäntö ei välttämättä taivu tällaiseen, koska tutkimusprotokollat vaativat selkeästi kuvatut menetelmät.
Kuva 2. Hajautetuilla ja virtuaalisilla mittauksilla saadaan tavanomaista yhtenäisempää ja jatkuvampaa tietovirtaa potilaan tilasta
Hajautetut ja virtuaaliset lääketutkimukset haastavat totuttuja toimintamalleja
Hajautettuihin lääketutkimuksiin liittyy edelleen merkittäviä haasteita, joista osa johtuu lääketutkimusten kalleudesta ja kestosta. Tutkimusta tukevat tahot eivät halua investoida aikaa ja rahaa, jos tutkimuksessa on riski epäonnistumiselle virtuaalisuudesta tai hajauttamisesta johtuen. Monet digitaaliset mittaukset tai datan tallennus eivät ole vielä laajasti testattuja kliinisten tutkimusten osalta. Tutkimuksen kannalta olisi katastrofaalista, jos sen tulokset kyseenalaistetaan.
Datan luotettavuuteen ja potilaiden yksityiseen liittyy monia haasteita. Potilaiden tunnistaminen ja etäsuostumus mainitaan usein haasteina kansainvälisesti, mutta erityisesti Suomessa näihin löytyy jo hyvin laajasti käytössä olevia ratkaisuja, jotka pohjautuvat vahvaan tunnistautumiseen. Potilaiden raportoimien tietojen luotettavuus ja vertailukelpoisuus vaatii erilaisia ratkaisuja kuin ammattilaisen kirjaamat tiedot. Esimerkiksi potilastietojärjestelmään kirjaamisen sijaan potilaalle pitää rakentaa käyttäjäystävällinen ja oikeaan tapaan ohjaava ratkaisu.
Digitaaliset työkalut maksavat. Jos tutkimusjärjestelyissä vain korvataan osa digitaalisella ratkaisulla, voi sen hyödyt jäädä rajallisiksi ilman muun tutkimuksen muuttamista. Esimerkiksi datan tallennukseen käytettävän alustan tulee tällöin pystyä automaattisesti tallentamaan tiedot ja tarkastamaan niiden oikeellisuus.
Kaikki haasteet eivät ole teknisiä tai liity suoraan digitaalisiin ratkaisuihin. Potilaiden oikeanlaisesta työkalujen käytöstä on vaikeaa varmistua ilman ammattilaisen läsnäoloa. Myös lääkeaineiden logistiikkaan liittyy haasteita, jos lääkeaineita halutaan annostella potilaiden kotona.
Ruotsi ja Tanska ovat Suomea edellä – ainakin paperilla
Sitra toteutti vuoden 2021 loppupuolella selvityksen Suomen tilanteesta liittyen hajautettuihin ja virtuaalisiin lääketutkimuksiin. Tässä selvitystyössä haastateltiin muun muassa lääkeyhtiöitä, lääkealan tutkimuspalveluyrityksiä ja viranomaisia Suomesta, Ruotsista ja Tanskasta. Ruotsissa ja Suomessa lääketutkimusten määrä on ollut laskeva. Tanskassa taas lääketutkimusten määrä on kasvussa ja niiden määrä kasvoi melkein 14 prosenttia vuodesta 2019 vuoteen 2020.
Merkittävä ero Suomen ja näiden kahden maan välillä on kliinisten lääketutkimusta edistävät organisaatiot. Tanskassa toimii Trial Nation, joka tarjoaa yhden luukun -palvelua lääketutkimusten toteuttamiseen, sponsorointiin tai niihin osallistumiseen. Se saa rahoitusta valtiolta ja viideltä terveydenhuoltoa järjestävältä alueelta. Klinikal Studier Sverige edistää kliinisiä lääketutkimuksia Ruotsissa ja toimii kuuden yhteistyöalueen alla. Rahoitus tulee Ruotsin tutkimusneuvostolta (Vetenskapsrådet). Sekä Tanskan että Ruotsin organisaatiot toimivat verkostomaisesti.
Suomessa ei ole vastaavia toimijoita. Suomeen on viime vuosina rakennettu tai suunnitteilla osaamiskeskuksia, kuten genomikeskus, kansallinen syöpäkeskus ja neurokeskus. Nämä osaamiskeskukset voivat mahdollisesti muun toiminnan lisäksi toimia lääketutkimusten kliinikoiden tai potilaiden rekrytointiin.
Ruotsin lääkeviranomainen Läkemedelsverket aloitti selvityksen hajautettujen ja virtuaalisten lääketutkimusten edistämiseksi vuonna 2020 havaittuaan, että lääketutkimusten määrä on laskussa. Tämän selvitystyön tuloksena vuonna 2021 aloitettiin viisi pilottitutkimusta, jotka kattavat eri faaseja ja erilaisia sponsoreita. Vinnova rahoittaa tuotekehitystä ja tutkimusta Ruotsissa. Pilottien tavoitteena on selvittää esteitä ja mahdollistajia hajautetuille ja virtuaalisille lääketutkimuksille. Suomessa vastaavia pilotteja ei ole selvityksen pohjalta suunnitteilla.
Tanskassa on hieman erilainen toimintaympäristö kuin Suomessa tai Ruotsissa. Tanskalaiset suuret lääkeyhtiöt Novo Nordisk, Lundbeck, LEO Pharma ja ALK ovat ainakin osittain säätiöiden omistamia. Tämän takia Tanskassa on paljon ei-kaupallisten sponsorien lääketutkimuksia. Tanskassa lääketeollisuus on merkittävästi suurempi toimiala (PDF) kuin Suomessa, joten vertailu on haastavaa. Tanska ei ole Suomesta ja Ruotsista poiketen kärsinyt laskevasta trendistä lääketutkimusten määrässä tai arvossa.
Tanskassa paikallinen viranomainen Lægemiddelstyrelsen on julkaissut ohjeistuksen (PDF) hajautettujen elementtien hyödyntämisestä lääketutkimuksissa. Ruotsin Läkemedelsverket taas julkaisee pilottitutkimuksien oppeja ”kysymykset ja vastaukset”-tyylisesti sivuillaan. Vaikka ohjeistus ja dokumentaatio on yleisluontoista, voi se kuitenkin toimia kannustimena ja markkinointina haastateltavien mukaan. Se myös osoittaa paikallisen viranomaisen positiivista ja kannustavaa suhtautumista liittyen uudenlaisiin tutkimusjärjestelyihin.
3. Rohkeaa markkinointia ja yhteistyötä
Suomella on erinomaiset edellytykset mahdollistaa hajautettujen lääketutkimusten määrän lisäämistä. Suomen vahvuuksia tulee tuoda rohkeammin esille samalla, kun toimintaympäristöstä kehitetään entistäkin kannustavampaa.
Suomi on monella tapaa edelläkävijä, mutta ei täysin tartu tilaisuuteen
Suomi tunnetaan erityisesti erinomaisista rekistereistään, joiden pohjalta tehdään monenlaista tutkimusta. Lääketutkimusten määrä on kuitenkin laskussa samoin kuin koko Euroopan alueella. Suomessa haettiin tutkimuslupaa vielä 2000-luvun alkupuolella noin 250 tutkimukselle vuosittain (PDF). Vuonna 2020 vastaava luku oli 123 (PDF). Määrällisesti suurin osa lääketutkimuksista liittyy syövän hoitoon. Pelkästään tutkimuslupien määrästä ei voida suoraan tehdä päätelmiä lääketutkimusaktiviteetin määrästä Suomessa, koska tutkimuslupiin on nykyään mahdollista hakea muutoksia ja tutkimusluvat voivat koskea monia eri faaseja tutkimuksessa.
Samaan aikaan lääkeyritysten investointien määrä Suomeen kasvaa. Pelkästään vuonna 2020 ne kasvoivat melkein 40 prosenttia. Tutkimukseen ja tuotekehitykseen investoitiin 258 miljoonaa euroa.
Suomella on joitakin selkeitä kilpailuetuja liittyen lupakäytäntöihin. Suomessa on ainoastaan yksi eettinen toimikunta, joka arvioi kliinisiä lääketutkimuksia. Suomessa myös tutkimusprotokolla voi olla englanniksi. Esimerkiksi Saksassa 53 eettistä toimikuntaa ja niiden työskentelykielenä on saksa. Suomen tasolla tehtävät linjaukset, jotka poikkeavat eurooppalaisista linjauksista, voivat olla kuitenkin haitallisia. Muista maista poikkeavat linjaukset tulevat olla lupaprosessia helpottavia.
Digitalisaation osalta Suomi on erinomaisessa asemassa. Potilastietojärjestelmät ja sähköiset rekisterit ovat kattavia. Monessa muussa maassa käytettyjen potilaskyselyiden sijaan Suomessa voidaan usein hakea tiedot suoraan potilasrekistereistä. Todellisessa käyttöympäristössä kerätty data (engl. real-world data, RWD) on jatkuvasti kansainvälisen keskustelun keskiössä, mutta Suomessa sitä löytyy kattavasti jo olemassa olevista rekistereistä. Suomalaiset ovat myös tottuneita teknologian käyttäjiä. Monissa sähköisissä palveluissa vahva tunnistautuminen on arkipäivää.
Suomessa on laadittu viime vuosina eteenpäin katsovaa lainsäädäntöä. Toisiolaki, genomilaki ja biopankkilaki ovat tärkeimmät esimerkit. Toisiolain tavoitteena on mahdollistaa terveystietojen laajempaa hyödyntämistä ja yhdistelyä muihin tietolähteisiin. Biopankkilaki muun muassa mahdollistaa näytteenantajien yhteydenoton esimerkiksi lääketutkimukseen kutsumisen takia. Genomilaki on valmisteilla. Sen tavoitteena on mahdollistaa genomitiedon käyttöä nykyistä paremmin.
Suomi on pienestä koostaan ja väestöpohjastaan huolimatta melko hajautunut maa. Tutkimuksia toteuttavien lääkäreiden rekrytoinnin vaikeus voi jopa estää tutkimuksen toteuttamisen erityisesti harvinaissairauksissa. Sponsorit joutuvat usein käyttämään merkittävästi resursseja löytääkseen tutkimuksen toteutukseen lääkäreitä.
Esimerkiksi Ruotsista löytyy verkosto alueellisia toimijoita, joiden kautta tutkimuslääkäreitä voidaan rekrytoida tehokkaasti. Suomessa esimerkiksi FinPedMed tarjoaa palvelua, jossa lastenlääketutkimusta suunnitteleva taho voi kerätä tutkimukseen pediatriaan keskittyviä kliinikoita ympäri Suomea. Suomessa rakennetaan tällä hetkellä osaamiskeskuksia, jotka voivat onnistuessaan helpottaa lääkäreiden rekrytointia.
Suomen tulee tuoda esille omia vahvuuksiaan ja helpottaa lääketutkimuksen toteuttamista
Kiinnostus virtuaalisia ja hajautettuja lääketutkimuksia kohtaan on vahvaa. Suomessa tehtävissä lääketutkimuksissa on jo nyt usein hajautettuja ja virtuaalisia elementtejä, kuten etäsuostumuksia tai sähköisiä kyselyitä.
Keskeisillä toimijoilla on ristiriitaisia näkemyksiä lääketutkimuksista. Osa on sitä mieltä, että Suomessa ei tarvita mitään muutoksia, kun taas toiset haluavat vahvasti proaktiivista ohjausta viranomaisilta ja rahoitusta hajautettujen lääketutkimusten toteutukseen. Esimerkiksi Suomen lupaviranomaisen Fimean roolista on erilaisia näkemyksiä. Osa haluaisi selkeitä proaktiivisia linjauksia, kun taas toiset arvostavat Fimean nykyistä toimintatapaa, jossa lääketutkimuksia suunnittelevat tahot voivat ehdottaa uusia toimintatapoja ja Fimea arvioi näiden sopivuutta ja tarkoituksenmukaisuutta.
Ehdotamme seuraavia toimenpiteitä Suomelle:
1.Toimintaympäristön dokumentointi ja selkeyttäminen
Suomen lääketutkimusten ekosysteemi ei ole täysin selkeä ja se on pirstaloitunut. Tutkimuksia toteuttavien kliinikoiden etsintä on hankalaa. Toiminta perustuu pitkälti ajan saatossa kertyneisiin kontakteihin ja tietoon toimintamalleista.
Toimintaympäristöä tulee selkeyttää. Aiemmin mainittujen osaamiskeskusten rooli on tärkeä. Niiden avulla voidaan helpottaa merkittävästi lääketutkimusten toteuttamista esimerkiksi tarjoamalla selkeä kanava tutkijalääkäreiden ja potilaiden rekrytointiin. Yliopistosairaaloiden ja tulevien sote-yhteistoiminta-alueiden roolia lääketutkimuksessa tulee myös suunnitella ja selkeyttää.
Tanskan kansallisen ja Ruotsin alueellisen mallin soveltuvuutta Suomeen tulee selvittää. Suomessa on valittu monessa tapauksessa osaamiskeskuksiin pohjautuva malli. Siinä ei itsessään ole vikaa, mutta valintojen erilaisten mallien välillä tulee olla tietoisia. Alueellinen malli ei vaadi merkittäviä investointeja, jos se toteutetaan verkostomaisesti ilman kiinteitä henkilöresursseja mukaillen Ruotsin mallia. Tällöin yliopistosairaaloiden muodostamat yhteistoiminta-alueet olisivat looginen taso verkostolle.
2. Suomen tulee markkinoida vahvuuksiaan nykyistä rohkeammin
Suomi on jo nyt monella tapaa hajautettujen ja virtuaalisten lääketutkimusten edelläkävijä. Käytössä on laajasti hyödynnettyjä ratkaisuja etäsuostumukselle, potilastiedot ovat jo pitkään olleet sähköisiä, nopeat tietoliikenneyhteydet kattavat lähes koko maan ja Fimea on viranomaisena avoin uusille tutkimusmenetelmille.
Toimintaympäristön vahvuuksia tulisi tuoda nykyistä reilummin esille. Suomi on erinomainen sijainti esimerkiksi lääkeyhtiöiden pilottitutkimuksille, joissa testataan hajautettuja menetelmiä. Suomen tarjoamia mahdollisuuksia ei tule piilotella, vaan tuoda esille rohkeasti.
3. Tarvitaan yhteistä keskustelua ja suunnittelua
Haastateltavat toimijat olivat harvinaisen yksimielisiä lääketutkimusten lisäämisen tärkeydestä. Kaikilla lääkeyhtiöillä on kokemuksia hajautettujen elementtien hyödyntämisestä. Myös viranomaiset voivat tuoda esille esimerkkejä hyväksytyistä uudenlaisista tutkimusprotokollista.
Kokemusten ja tietojen jakaminen hyödyttää kaikkia. Tätä työpaperia kirjoitettaessa lääketutkimukseen liittyvät toimijat ovat aloittaneet yhteisen foorumin suunnittelun.
4. Yleishyödyllisiä pilottitutkimuksia kaivataan
Akateemisten sponsoreiden toteuttamat pilotit ovat arvokkaita ja niiden kautta muut toimijat voivat saada uusia toimintatapoja ja rohkeutta tehdä uudenlaisia tutkimuksia.
Pilottitutkimukset tulee rakentaa siten, että ne testaavat pääasiassa hajautettuja toimintamalleja: tutkimuksissa tulee esimerkiksi hyödyntää terveyskeskuksia ja tulevia sote-keskuksia sairaalan sijasta tai digitaalisin työvälinein valvottuja potilaan itseannostusta kotona. Piloteissa pitäisi välttää keskittymistä pelkästään valittuihin lääkeaineisiin. Tällaisia tutkimuksia voidaan hyödyntää laajasti muiden tutkimusten suunnittelussa ja toteutuksessa.
5. Koulutusta ja osaamista tulee lisätä
Lääketutkimukset vaativat erikoisosaamista sekä tutkijalääkäreiltä että tutkimushoitajilta. Tutkimustyö ei ole kuitenkaan houkuttelevaa tällä hetkellä. Lääketutkimusten kliinikot tekevät lähes poikkeuksetta myös tavallista hoitotyötä, mutta lääkäreistä on jo nyt pula. Nykyisestä riittämättömästä määrästä lääkäreitä on vaikeaa irrottaa henkilötyöpanosta tutkimusten tekemiseen julkisella puolella. Ilman lääkäreiden määrän lisäämistä ei lääketutkimuksillekaan riitä riittävästi tekijöitä.
Valtion rahoituksella on keskeinen rooli tavallisesta hoitotyöstä irtautumiselle tutkimusta varten. Esimerkiksi yliopistosairaaloiden erityisvaltionosuus (EVO) on mahdollistanut lääkäreiden irtautumisen tutkimustyöhön, mutta tämä rahoitus on laskenut tasaisesti. Erillistä tutkimus ja kehitysrahoitusta ei hyvinvointialueille tai erityisvastuualueille ei ole olemassa. Tämän tutkimusrahoituksen merkitystä osaamisen kehitykselle ei voi unohtaa.
Lähteet
Alexander, W. 2013. The Uphill Path to Successful Clinical Trials.
Burton, P. 2021. The Danish Foundation Model: Benefits Abound.
Center for Information and Study on Clinical Research Participation (CISCRP). 2017. Report on General Perceptions and Knowledge on Clinical Research (PDF).
Clinicaltrials.gov. 2022. Trends, Charts, and Maps. (haettu 25.4.2022)
Clinical Trials Analysis. 2021. Europe accounts for 19.3% share of global clinical trial activity in 2020. (haettu 25.4.2022)
Clinical Trials Arena. 2021. 2022 forecast: decentralised trials to reach new heights with 28% jump
Dimasi, J., Grabowski, H. ja Hansen, R. 2016. Innovation in the pharmaceutical industry: New estimates of R&D costs.
European Federation of Pharmaceutical Industries and Associations. 2021. The Pharmaceutical Industry in Figures (PDF).
Fimea. 2012. Kliinisten lääketutkimusten tilasto 2011 (PDF).
Fimea. 2021. Kliinisten lääketutkimusten tilasto 2020 (PDF).
Fält, R. 2021. Trial Nation – one point entry to clinical trials in Denmark. (haettu 25.4.2022)
Joensuu, H. 2017. Miksi kliinistä lääketutkimusta on tarpeen tehdä myös Suomessa?. (haettu 25.4.2022)
Lægemiddelstyrelsen. 2021. Årsrapport for kliniske forsøg med lægemidler i 2020.
Läkemedelsverket. 2021. Statistik. (haettu 25.4.2022)
Lääkärilehti. 2020. Valtion terveystutkimuksen rahoitus pienenee taas.
Lankila T., Kotavaara, O., Antikainen, H., Hakkarainen, T. ja Rusanen J. 2016. Sosiaali- ja terveyspalveluverkon kehityskuva 2025 – Paikkatieto- ja saavutettavuusperusteinen tarkastelu.
MDGroup. 2020. The True Cost Of Patient Drop-outs In Clinical Trials. (haettu 25.4.2022)
Moore T., Zhang H., Anderson G., Alexander GC. 2018. Estimated Costs of Pivotal Trials for Novel Therapeutic Agents Approved by the US Food and Drug Administration, 2015-2016.
Orion. Lääkekehitys. (haettu 25.4.2022)
Piirainen, K., Järvelin, A., Koskela, H., Lamminkoski, H., Halme, K., Laasonen, V., Talvitie, J., Manu, S., Ranta, T., Haavisto, I., Rissanen, A. & Leskelä, R. 2019. Toimintamalleja sosiaali- ja terveysalan tutkimuksen, kehittämisen ja innovaatiotoiminnan edistämiseen.
Tamminen, N. 2021. Lääkeyritysten investoinnit kasvoivat selvästi yli kolmanneksen viime vuonna. (haettu 25.4.2022)
Tenaerts, P. 2022. Financial modeling from Tufts Center for the Study of Drug Development demonstrates substantial net benefits to sponsors who use decentralized clinical trials (DCTs) technology (PDF).
Wong, C. ja Siah, K. Estimation of clinical trial success rates and related parameters.
Wouters, O., McKee, M. ja Luyten J. 2020. Estimated Research and Development Investment Needed to Bring a New Medicine to Market, 2009–2018. (haettu 25.4.2022)
Xerimis. 2021. Decentralized Clinical Trials: Advancing the Trend Toward Patient-Centric Studies. (haettu 25.4.2022)


















Suosittelemme
Tästä eteenpäin.